PD-1抑制剂帕博利珠单抗(商品名可瑞达,俗称K药)在中国获批肺癌一线治疗了!这是免疫疗法首次在中国获批后扩大适应症。“K药+化疗”的客观缓解率是单用标准化疗的两倍以上,48% vs 19%。无论PD-L1表达水平高低,患者整体都能从“K药+化疗”中获益。

国家药品监督管理局批准帕博利珠单抗(商品名可瑞达,俗称K药)联合培美曲赛和铂类化疗(顺铂或卡铂)一线治疗无EGFR或ALK基因突变的转移性非鳞状NSCLC。K药是全球首个获批进入到肺癌一线联合化疗的免疫药物。这次在中国批准的是K药联合化疗,用于治疗非小细胞肺癌中的非鳞癌患者。
这个适应症在美国于2017年被加速获批,在欧洲于2018年9月获批。为加快新药进入中国速度,加强创新药在境内外同步上市的力度,今年中国药监局出台了允许使用境外临床数据的新规,K药正是由此被纳入了加速审评审批的名单。
有效率提高2倍,肺癌患者福音
该适应的批准是基于关键性III期临床研究KEYNOTE-189的数据。该研究由默沙东和礼来联合开展,这是一项随机、多中心、双盲、阳性对照研究,入组的患者为系统性疗法初治的转移性NSCLC患者,无论PD-L1肿瘤表达状态如何,并且不存在EGFR或ALK基因组肿瘤畸变。
此项研究患者随机分配至2个治疗组:
(1)Keytruda治疗组(n=410),接受Keytruda(200mg)+铂类化疗(顺铂或卡铂)+培美曲赛静脉输注(Q3W)治疗4个周期,之后接受Keytruda(200mg)以及培美曲赛静脉输注(Q3W);
(2)单纯化疗组(n=206),接受铂类化疗(顺铂或卡铂)+培美曲赛静脉输注(Q3W)治疗4个周期,之后接受培美曲赛静脉输注(Q3W)。
数据结果显示,与单纯化疗组相比:
1)总生存改善,死亡风险降低一半:Keytruda治疗组OS实现了统计学意义和临床意义的显著改善(中位OS:未达到 vs 11.3个月,HR=0.49[95%CI:0.38-0.64],p<0.00001);
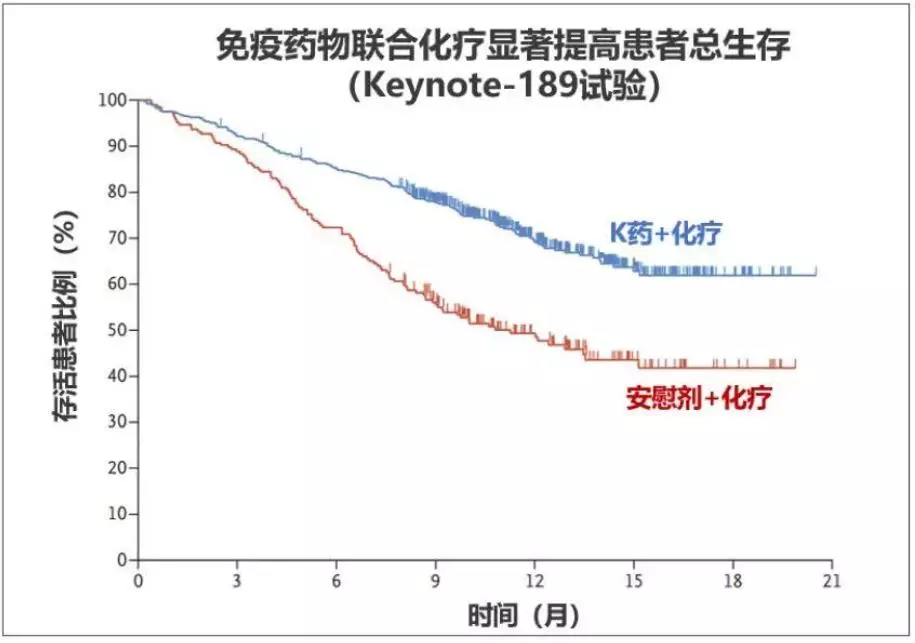
▲PD-1联合化疗显著延长患者总生存
2)显著延长无进展生存:与单纯化疗组相比,Keytruda治疗组PFS也实现了显著改善(中位PFS:8.8个月 vs 4.9个月,HR=0.52[95%CI:0.43-0.64],p<0.00001);
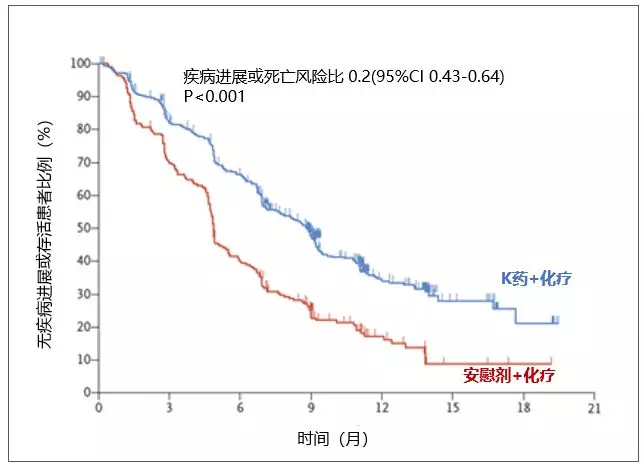
▲PD-1联合化疗显著延长患者无进展生存
3)客观缓解率ORR提高至2倍以上:48% vs 19%,p<0.00001;
4)显著延长缓解持续时间DOR:11.2个月 vs 7.8个月。
这些数据显示,PD-1正在改变这类患者的生存期望。
划重点,潜在获益肺癌群体更大
1无论PD-L1表达状态如何,PD-1抗体联合化疗均有很大的临床获益,可用于无EGFR或ALK基因突变的转移性非鳞状NSCLC的一线治疗;

2PD-1抗体联合化疗一线治疗绝不仅限于非鳞状NSCLC,中国药监局出台了允许使用境外临床数据的新规,K药这一适应症的获批也有力证实了这一政策,那就不得不提K药在FDA获批的另一适应症:2018年11月1日,美国食品和药物管理局(FDA)已批准可瑞达一个新的适应症,联合化疗(卡铂+紫杉醇或白蛋白结合型紫杉醇)用于转移性鳞状非小细胞肺癌患者的一线治疗,无论其肿瘤PD-L1表达状态如何。研究显示,与化疗相比,可瑞达与化疗联合应用显著延长了总生存期(可瑞达+化疗组15.9个月;化疗组 11.3个月)、死亡风险显著下降36%。相信不久之后,PD-1抗体联合化疗也将在国内获批鳞状NSCLC一线治疗适应症;
3 PD-1联合化疗逐步全面占领肺癌晚期一线治疗地位。
前沿方案
PD-1联合化疗一线治疗肺癌患者 (鳞癌/腺癌)临床招募进行中。
招募患者类型:
1 组织学检查确认的非小细胞肺癌(鳞癌/腺癌)
2 既往未曾接受过用于晚期或转移性NSCLC的全身治疗;
3 对于既往曾接受过含铂辅助化疗、新辅助化疗或针对进展期疾病接受过根治性放化疗的患者,如果疾病进展发生在最后一次治疗结束之后>6 个月,则有资格参加本研究;
4 无EGFR基因突变且无ALK基因融合;
5 存在至少一个可测量病灶(RECIST 1.1);
报名方式:微信公众号:ai帮帮 招募专员微信:wanjian59
最新资讯
新闻热点